来源:发表时间:2021-01-14 09:04:11 发布:0
2021年1月12日,由九芝堂美科(北京)细胞技术有限公司(以下简称“九芝堂美科”)发起的我国首个使用进口干细胞治疗缺血性卒中的Ⅰ/Ⅱa期临床试验(ASSIST)启动会在组长单位首都医科大学附属北京天坛医院通过线上会议形式顺利召开,标志着临床试验正式启动。

本次临床试验的主要研究者是首都医科大学附属北京天坛医院院长王拥军教授 ,王院长在致辞中说到:“这是国家把干细胞作为药物监管以来,第一个按照新版《药物临床试验质量管理规范》进行的干细胞治疗脑血管疾病的临床试验,这次试验对于干细胞进入脑血管疾病领域的临床应用和干细胞应用整个管理体系的改变都非常重要。”
这是一项评估向缺血性卒中患者单次注射缺血耐受人同种异体骨髓间充质干细胞(it-hMSC)的多中心、盲法、随机、安慰剂对照的安全性、耐受性和初步疗效的Ⅰ/Ⅱa期研究(ASSIST),试验将分为两个阶段进行。第一阶段为剂量爬坡的开放性研究,第二阶段为双盲对照研究。接下来,将按计划招募约60名缺血性卒中患者参与临床试验。
九芝堂美科的此项新药临床试验申请(IND)于2020年2月19日获得了CDE默示许可。因在美科IND之前,获批的前5项IND使用的干细胞均为国产,细胞来源包括脐带、脂肪等,涉及的适应症有膝骨关节炎、糖尿病足溃疡、移植物抗宿主病等。九芝堂美科获批的本项临床试验是按照药品申报方式开展的国内首个干细胞治疗神经系统疾病大适应症的临床试验,因此从PreIND沟通会到最终获得默示许可,受到了国家食品药品监督管理局的密切监管和支持。本项临床试验已经经过组长单位伦理委员会审核批准并在中国人类遗传资源管理办公室备案,最终正式启动。
本次临床试验所用it-hMSC产品由美国Stemedica Cell Technologies, Inc.(以下简称“Stemedica”)生产。Stemedica公司成立于2005年,2010年获得了美国加利福尼亚州政府颁发的生产许可证,至今已经在GMP条件下运行了10余年时间,是世界上少数能够在cGMP条件下生产骨髓间充质干细胞和神经干细胞产品的企业。Stemedica公司生产的it-hMSC产品全程在模拟人体真实生理环境——低氧条件下培养,性能优于常氧条件下培养的干细胞,其生产工艺和质量体系符合美国FDA 和cGMP 要求。该产品在美国已经获得8项IND,被Life Technology公司(已被赛默飞收购)评为“同类最佳”产品。
2019年,Stemedica在美国使用同款产品完成了治疗缺血性卒中的I/IIa期临床试验。结果显示,it-hMSC治疗安全性良好,经it-hMSC治疗的患者在精神状态、抑郁程度、生活自理能力等方面均获得显著性改善,初步证明了干细胞治疗的有效性。试验结果于2019年9月在国际卒中领域专业期刊《Stroke》发表。
据clinicaltrials网站数据,截止到2021年1月8日,全球开展干细胞治疗卒中的I、II、III期临床试验共计75项,其中美国25项、中国18项 (台湾7项)、欧洲11项、韩国3项、日本1项,其他国家17项。九芝堂旗下雍和启航基金参与投资的Stemedica公司的临床试验包含在其中。
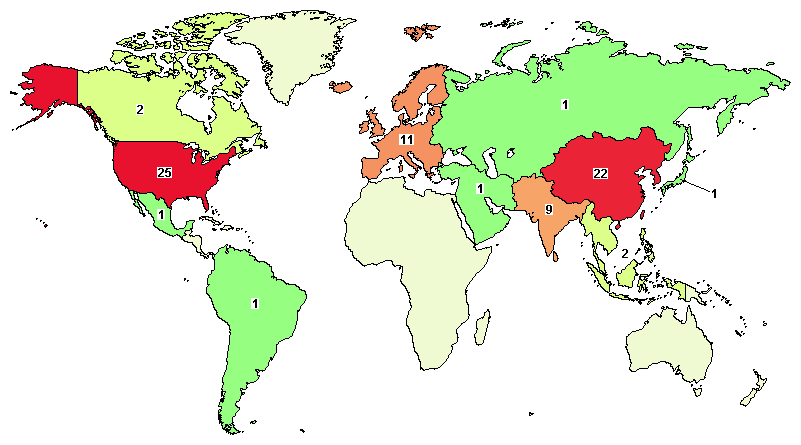
干细胞治疗卒中临床试验地理分布图
2017年,九芝堂发起设立了珠海横琴九芝堂雍和启航基金(以下简称雍和启航基金)。2018年,雍和启航基金投资了Stemedica公司。同时在北京投资成立九芝堂美科(北京)细胞技术有限公司,作为Stemedica干细胞技术在中国的唯一承接方。九芝堂美科已经在有“中国药谷”之称的北京大兴生物医药基地建成了同时符合中国和美国cGMP标准的生产研发基地。未来,九芝堂美科将与Stemedica携手,共同开发治疗卒中的干细胞药物,为饱受卒中后遗症困扰的广大患者带来福音。
自本临床试验信息披露之后,有很多患者及其家属通过各种方式咨询详细细节以及病人纳入排除标准,现公布如下:
入组基本条件:
1. 男性和女性≥18岁;
2. 病史显示,最近一次临床诊断为缺血性卒中的时间超过6个月;
3. 首次诊断时和入选时的MRI结果均提示患有缺血性卒中并存在功能障碍;
4. 入选研究前2个月神经功能或功能缺陷没有实质性改善;
5. 存在与第2条中的诊断相关的严重神经功能障碍,导致受试者需要他人协助才能行走,或不能独立完成一般日常生活活动;
6. 入选时NIHSS得分6-20;
7. 预期寿命大于12个月;
8. 治疗前,患者接受了缺血性卒中二级预防标准医疗护理,包括但不限于适当的血压和胆固醇控制措施、使用抗血小板药或抗凝药物(禁用情况除外);
9. 能理解并提供已签字的知情同意书,或者让指定的法定监护人或配偶自愿代表受试者做出上述决定;
10. 合理期待患者将得到缺血性卒中二级预防标准医疗护理,并参加所有计划的安全随诊。
11. 没有严重的器官功能障碍。
备注:符合各项要求,并经本研究项目医师审核后方可获得入组资格。最终解释权归研究科室所有。
哪些人不适合参加本研究?
1. 有癫痫、肿瘤、脑肿瘤、脑外伤病史;
2. 乙肝五项表面抗原、e抗原、e抗体和核心抗体任意一项阳性,丙型肝炎病毒抗体阳性,梅毒血清抗体阳性或艾滋病毒抗体阳性;
3. 参与试验前6个月内发生心肌梗塞;
4. 患有其他任何具有临床意义的医学疾病,或存在精神或检验结果异常,经研究者或申办方判定参加试验会给受试者带来安全风险;
5. 影像学检查提示过去12个月内出现蛛网膜下腔出血或脑内出血;
6. 治疗前3个月内参与另一项使用试验药物或设备的研究;
7. 参与过其它干细胞治疗相关研究;
8. 过去一年吸毒或酗酒史;
9. 已知怀孕、哺乳或妊娠测试阳性(将在筛查过程中进行检测)或计划在试验期间怀孕的女性;
10. 对牛和猪肉产品过敏。
计划招募人数:约60名
经筛选后符合条件并进入该研究,您将获得申办单位提供的研究治疗药物及相关检查。
本文网址:http://zgymei.com/yimei/2433.html
声明:本站原创/投稿文章所有权归健康日报网所有,转载务必注明来源;文章仅代表原作者观点,不代表健康日报网立场;如有侵权、违规,可直接反馈本站,我们将会作删除处理。
上一篇 : 2021年,亚太市场Abit交易所来了
下一篇 : 蓝跃鱼油,你还不知道吗!


2023-05-31 10:27:38

2023-05-31 10:22:23

2023-05-30 10:21:47

2023-05-30 10:15:41

2023-05-26 10:01:41

2023-05-09 16:18:19

2023-05-06 09:51:33

2023-05-04 10:11:21